| НА ГЛАВНУЮ |
ПАРТНЕРЫ
Переливание крови у кошек и собак

George Lubas DVM Университет Пизы, Италия
Джордж Любас является доцентом по Сравнительной клинической гематологии Института специальной Патологии и Ветеринарной Клинической Медицины Университета Пизы, Италия.
Резюме
- Собаки редко обладают высоким титром естественно возникающих антител против эритроцитов.
- Реакции на первое переливание крови у собаки являются редкими.
- Доноры крови для собак должны по меньшей мере иметь негативную реакцию на DEA 1 антиген.
- Кошки с группой крови В встречаются редко, но они очень часто имеют высокие уровни естественно возникающих антител к А-антигену.
- Несовместимые трансфузии у кошек могут вызвать острые реакции.
- При трансфузиях у кошек очень важно определить группы крови и выполнить перекрестные пробы на совместимость.
Введение
Лечение переливанием крови в ветеринарии за последние годы пережило быстрый рост, особенно у домашних животных, и некоторые исследования документально подтвердили его пользу при ряде гематологических заболеваний. Много обзоров было опубликовано по смежным темам: таким как группы крови у собак и кошек, иммуногематологичсские характеристики как у собак, так и у кошек: показания к переливанию крови; этические и клинические исследования, касающиеся животных-доноров; производство и хранение препаратов крови (1,3, 4, 6, 7).
Иммуногематологические особенности у собак
С тех пор как в 50-х годах были опубликованы первые исследования в этой области, у собак было определено несколько групп крови. Номенклатура групп крови отражает расхождение мнений нескольких авторов, участвовавших в этих исследованиях, и в настоящее время равнозначно применяются две различные классификации:
- DEA = Эритроцитарный Антиген Собаки (напр. DEA 1).
- Заглавная буква для системы и строчная отдельная буква для фактора (напр.. Са). Иногда прибавляется номер для подтипа (напр., Аа1).
Антигены различных групп крови распознаются специфическими антителами в результате прямых или непрямых реакции (т. с. антиглобулинового теста) агглютинации и гемолиза. Некоторые из этих реакций могут проходить только при определенных температурах (напр., 4°С, 25°С или 37°С). Распределение различных групп крови по породам не изучено в деталях, хотя и сообщалось, что грейхаунды имели очень низкую частоту проявления антигенов DEA 1.1 и 1.2 (2, 6, 9) (Таблица 1).
|
Номенклатура |
Тип реакции для определения антител |
Частота появления реакции у собак смешанных пород |
|||||
|
DEA |
Система |
Факторы |
Агглюти нация |
Антиглобулин |
Гемолиз |
||
|
1.1 А 1.2 |
а1 |
+ |
+ |
+ |
41,3 |
||
|
а2 |
+ |
+ |
- |
9,1 |
|||
|
аЗ |
+ |
+ |
- |
9,1 |
|||
|
3 |
B |
а |
+ |
- |
- |
5,5 |
|
|
4 |
C |
а |
+ |
- |
- |
99,8 |
|
|
5 |
D |
а |
+ |
(+) |
- |
22,4 |
|
|
6 |
F |
а |
+ |
- |
- |
100,0 |
|
|
7 |
Tr |
tr |
+ |
- |
(+) |
40,7 |
|
|
о |
+ |
- |
(+) |
31,1 |
|||
|
J |
а |
- |
+ |
- |
34,4 |
||
|
K |
А |
- |
+ |
- |
2,0 |
||
|
L |
А |
- |
+ |
- |
51,0 |
||
|
M |
А |
- |
+ |
- |
19,0 |
||
|
N |
А |
+ |
+ |
- |
61,6 |
||
+ = выбранный метод; (+) = альтернативный метод; - = нет реакции.
Очень немногие группы крови определены как значимые для лечения трансфузией, хотя группы DEA 1.1, 1.2 и 7 являются наиболее распространенными антигенными факторами. У собак, как признано, естественно возникающие антитела являются очень редкими и, если они присутствуют в сыворотке, то в низких титрах или вступают в реакцию при температурах, отличных от температуры тела. На самом деле только около 15% собак демонстрируют естественно возникающие антитела к DEA 3, 4, 5 и 7. Появление таких естественно возникающих антител не следует путать с приобретенными антителами к группам крови. Первые нс связаны с каким-либо проявлением иммуностимуляции, в то время как при последних имеется мощная иммунная реакция, вызванная, например, переливанием несовместимой крови (2,6,9).
Именно вследствие этих иммуногематологических особенностей крайне редко встречается реакция на первую трансфузию при переливании собаке несовместимой крови (2,3,6,9).
Иммуногематологические особенности у кошек
Главная группа крови у кошек обозначается как АВ и состоит из трех типов крови. Ее серологические и антигенные характеристики показаны в Таблице 2. Недавно была определена биохимическая структура групповых антигенов кошачьей крови. Они представляют собой гликолипиды и гликопротеины, которые отличаются компонентом нейраминовой кислоты (6-8).
|
Эритроциты Фенотип |
Генотип |
Реакция Анти-А |
Антисыворотки Анти-В |
Характеристика естественных антител в сыворотке Тип Частота Титр |
Частота Антигена |
|
|
А В |
А/А А/В |
пол. |
отр. |
анти-В |
редкая 1:2 ± 1:4 низкая |
высокая 80-90% |
|
В/В |
отр. |
пол. |
анти-А |
Высокая 1:128 высокая |
низкая 10-20% |
|
|
АВ АВ/АВ пол. |
пол. |
отсут. |
Отсут. отсут. |
редкая |
||
Группа крови (фенотип) А- В- никогда не был найден.
пол. = положительная; отр. = отрицательная
Группа крови А представлена в основном в популяциях домашних коротко- и жесткошерстных кошек. Эти кошки очень редко имеют в своей сыворотке высокие уровни естественно возникающих антител. Напротив, кошки с группой крови В встречаются редко, зато очень часто имеют в сыворотке высокие уровни естественно возникающих антител к А-антигену. Заметные различия в частоте этих групп крови могут возникать в популяциях породистых кошек, где на распределение групп крови повлияли методы селективного разведения пород (Таблицы 3 и 4) (6-8).
|
Нация |
Число тестированных кошек |
Группа А (%) |
Группа В (%) |
|
Австрия |
81 |
96,3 |
3,7 |
|
Англия |
477 |
97,1 |
2,9 |
|
Финляндия |
32 |
100,0 |
0,0 |
|
Франция |
350 |
85,1 |
14,9 |
|
Германия |
600 |
94,0 |
6,0 |
|
Италия |
363 |
87,1 |
12,9 |
|
Голландия |
95 |
95,8 |
4,2* |
|
Шотландия |
70 |
97,1 |
2,9 |
|
Швейцария |
1.018 |
99,6 |
0,4 |
|
Австралия |
1.895 |
73,3 |
26,7* |
|
Япония |
299 |
89,3 |
11,7* |
|
США |
1.072 |
99,7 |
0,3 |
* Включают процент кошек А+ В+: Голландия =1%, Австралия =0,4% Япония =9,7%.
|
Порода |
Число тестированных кошек |
Группа А (%) |
Группа В (%) |
|
|
Абиссинская |
194 |
79,9 |
20,1 |
|
|
Бирманская |
216 |
82,4 |
17,6 |
|
|
Британская короткошерстная |
85 |
41,2 |
58,8 |
|
|
Бурмес |
25 |
100,0 |
0,0 |
|
|
Девонский Рекс |
100 |
57,0 |
43,0 |
|
|
Гималайская |
35 |
80,0 |
20,0 |
|
|
Персидская |
170 |
75,9 |
24,1 |
|
|
Шотландский фолд |
27 |
85,2 |
14,8 |
|
|
Сиамская |
99 |
100,0 |
0,0 |
|
|
Сомалийская |
27 |
77,8 |
22,2 |
|
|
Тонкинская |
31 |
100,0 |
0,0 |
|
|
А- В-кошки никогда не были обнаружены. |
||||
Есть и практические последствия этих иммуногематологических особенностей у кошек: если переливается перекрестно-совместимая кровь, продолжительность жизни эритроцитов у реципиента составляет около 4-5 недель. Если же используется несовместимая кровь, то продолжительность жизни эритроцитов может упасть от нескольких часов до нескольких дней. Кроме того, несовместимые трансфузии могут вызвать острую реакцию, особенно тяжелую, если эритроциты группы крови А вводятся кошкам группы крови В даже в первый раз (6-8).
Общие показания к переливанию крови
Переливание крови может быть полезным при некоторых гематологических заболеваниях. Основные показания, в порядке значимости и современного применения, следующие (3,4, 6-8):
- Острая кровопотеря.
- Острая гемолитическая анемия.
- Невосстанавливающаяся анемия с гематокритом (PCV) между 12 и 15%.
- Наследственная или приобретенная коагулопатия
- Тромбоцитопения/патия
- Лейкопения
- Гипопротеинемия (при ограничениях для применения плазмы).
Параметры, которые подтверждают необходимость срочной трансфузии (3,4,6-8):
- Быстрое уменьшение циркулирующего объема (< 30%)
- PCV менее чем 20% или 15% (соответственно для собаки и кошки)
- Непрерывное кровотечение или гемолиз
- Плохая реакция на традиционное лечение
- Бледные слизистые оболочки
- Повышенное время заполнения капилляров (> 2 секунд).
- Тахикардия
- Тахипноэ
При оценке потребности в трансфузии клиницист должен принимать во внимание некоторые другие факторы (3,4,6-8):
- Степень анемии и скорость кровопотери.
- Реакцию костного мозга, определенную посредством подсчета ретикулоцитов в мазках периферической крови или аспиратах костного мозга.
- Причину анемии, которая дала бы ценные прогностические указания.
При ветеринарии необходимо также принимать в расчет этику и закон о защите донора, оснащение соответствующими инструментами для сбора и введения крови. В конце концов не следует пренебрегать и экономическими соображениями относительно применяемых веществ и профессионального надзора над их введением (3, 6-S).
Совсем недавно более пристальное внимание стали уделять аутологичной трансфузии. Эта процедура исключает любую опасность неблагоприятной иммуногематологической реакции или передачи заболевания и может быть использована во время большой полостной операции. Кровь извлекается из полостей тела и повторно вводится в кровеносную систему с помощью соответствующих фильтровальных устройств. Также возможно взять кровь за 2-3 недели до ожидаемой операции, хранить ее соответствующим образом и, если это необходимо, вводить ее по ходу операции (3, 6,7).
Выбор донора и сбор крови
Собака-донор должна соответствовать следующим требованиям (1,3,5-7):
- Вес свыше 25 кг.
- Возраст от 2 до 8 лет.
- Спокойный характер.
- PCV выше40%.
- Регулярная вакцинация против основных инфекционных болезней, таких, как чума, инфекционный гепатит, лептоспироз, парвовирусная инфекция и бешенство.
- Клинически здорова (рекомендуется полный подсчет форменных элементов крови и исследование ее биохимического профиля).
- Контроль на некоторые инфекционные заболевания в зависимости от географической местности (бабезиоз, лейшманиоз, эрлихиоз, боррелиоз, бруцеллез и дирофиляриатоз).
- Исключаются группы крови DEA 1.1,1.2 (А) или DEA 7 (Тг), хотя есть сомнение, является ли DEA 7 значимым в реакциях на трансфузию.
- Не должно быть естественно возникающих изоантител к эритроцитам в сыворотке.
- Собаке должна быть сделана обычная коагулограмма, потому что донорская кровь может стать источником тромбоцитов и факторов коагуляции.
Кровь обычно берется из яремной вены асептическим способом (место взятия крови должно быть выстрижено и хирургически обработано). Взятое количество не должно превышать 20 мл/кг при максимальной частоте 1 раз в три недели. Постоянным донорам следует давать добавку железа в виде 10 мг/кг сульфата железа ежедневно. Рекомендуется применять коммерческие наборы для взятия крови, такие как пластиковые мешки из поливинилхлорида (PVC), предварительно наполненные цитратом фосфата декстрозы и аденином (CPDA-1) в соотношении 14 мл антикоагулянта на 100 мл крови. Кровь может храниться до 35 дней, если содержится при 4-6°С, или из нее могут быть приготовлены некоторые препараты крови. Сбор крови обычно производят непосредственным наполнением донорского мешка. При этом следят за равномерным смешиванием ее с антикоагулянтом. Ускоренное наполнение может быть достигнуто помещением мешка в вакуумную камеру (1, 3, 5-7).
Кошка-донор должна иметь следующие характеристики (3, 6-8):
- Вес между 5 и 7 кг.
- Возраст от 2 до 8 лет.
- Кастрированная и со спокойным характером.
- PCV выше35%.
- Регулярно вакцинированная (кальцивироз, вирус герпеса панлейкопения, хламидиоз и бешенство).
- Клинически здоровая и протестированная на Haemobartonellafelis и на вирусы лейкоза (FeLV), иммунодефицита (FIV) и инфекционного перитонита (FIP).
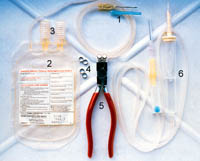
Рисунок 1 Набор инструментов для взятия и хранения крови человека, который может быть приспособлен и для собак. Он включает (1) входную трубку с иглой (обычно 18G), которая ведет к (2) мешку объемом 250 мл для цельной крови, обработанной 35 мл CPDA-1 в качестве антикоагулянта. Этот мешок имеет 2 выходных отверстия (3), (4) несколько алюминиевых герметизирующих колец, чтобы закрывать проводящую систему; (5) многофункциональный зажим, который дает возможность удалять кровь из донорской системы, герметик для обжатия алюминиевых колец и режущий инструмент, чтобы разрезать систему между герметиками; (6) стандартный набор для введения крови с наконечником для облегчения проникновения в мешок с кровью, фильтр для сгустков (обычно с порами 170-230 им в диаметре), капельницу, проводящую систему реципиента с адаптером иглы и зажимом для контроля потока.
Определение группы крови кошек-доноров позволяет, когда кровь необходима, быстро и правильно выбрать донора, если известна группа крови больного.
С целью обеспечения необходимой фиксации перед взятием крови кошку-донора подвергают анестезии или воздействуют на нее седативными препаратами. Во время взятия крови следует постоянно контролировать PCV, а кошка должна получать физиологический раствор в количествах в 2-3 раза больше объема взятой крови, который вводится либо внутривенно, либо внутрибрюшинно. Каждые 3 недели может быть взято до 11 мл крови на килограмм веса кошки-донора. Если собранная кровь должна быть немедленно перелита больному, рекомендуется использовать большие шприцы, содержащие одну часть 3,8% раствора цитрата натрия на 9 частей крови. Свертывания крови можно избежать путем обработки шприца 15 IU/ml гепарином. Однако, гепарин вызывает агрегацию тромбоцитов и подавляет факторы коагуляции (Рисунок 2). В случае длительного хранения наилучшим антикоагулянтом, как описано выше, является CPDA-1 (3,6-8).

Рисунок 2 Взятие крови при помощи 50 мл шприца с добавленным антикоагулянтом (в данном случае CPDA-1) через иглу-бабочку 21G из яремной вены кошки, находящейся под воздействием седативных веществ.
Возможности получения донорской крови
Существует по меньшей мере три разных пути получения доноров и соответственно донорской крови. Принятый подход будет зависеть от индивидуальных потребностей каждой ветеринарной практики (5,6,7). Следует помнить, однако, что использование животных в качестве доноров связано с этическими проблемами как для клинициста, так и для владельца животного, и на самом деле во многих странах является незаконным.
Доноры в закрытой колонии
Животные содержатся в закрытом помещении.
Преимущества:
- Клинические. Легко выбрать донора, поскольку они имеют известный тип крови.
- Заболевание. Животные полностью лишены возможности заболеть инфекционными болезнями, передаваемыми с кровью.
- Отсутствие стресса. Животные испытывают минимальный стресс и беспокойство во время процедуры взятия крови, поскольку они привыкли к этому процессу.
Недостатки:
- Этические. Животные используются исключительно с целью взятия крови. Забота о животном может быть направлена только на поддержание его здоровья и ограничена тем периодом, в который оно может быть использовано как донор. После этого срока должна быть сделана любая попытка для помещения его в приют для животных.
- Финансовые. Значительные суммы тратятся на содержание и уход за донорами.
Общественные доноры
Местные владельцы животных предлагают своих любимцев для донорства на добровольной основе.
Преимущества:
- Хозяева животных принимают непосредственное участие в программе.
- У животных определяется тип крови, осуществляется ветеринарный контроль, включая обследования на заболевания, передаваемые с кровью.
- Взятия крови являются менее частыми (раз в 2-3 месяца).
Недостатки:
- Повышенная опасность переносимых с кровью инфекционных болезней, если кровь не проверяется при каждой сдаче.
- Значительно повышаются расходы и происходят задержки в получении подходящей крови. Конечный продукт имеет укороченный срок хранения и является более дорогим.
- Доноры потенциально могут испытывать неблагоприятные ощущения или стресс от процедуры взятия крови.
Доноры из ветеринарной клиники
Многие практикующие врачи выбрали путь содержания животных-доноров, часто принадлежащих персоналу клиники, непосредственно в клинике или рядом с ней. Преимущества и недостатки этого подхода схожи с уже подчеркнутыми выше для общественных доноров. Кроме того, животные, постоянно находящиеся в клинике, имеют повышенный риск приобретения больничных инфекций. Зато кровь, собранная от этих доноров, почти всегда используется как свежая или консервированная цельная кровь, а не как ее обработанные компоненты.
Приготовление и применение цельной крови и препаратов крови
В ветеринарии, в отличие от человеческой медицины, методы трансфузии и приготовления препаратов крови не развивались столь интенсивно и переливание цельной крови пока еще остается основным, принятым всюду методом. Однако, если у собак нередко примененяются препараты крови, то у кошек имеются ограничения, вызванные малым объемом крови, которая может быть собрана (1,3-7). Производство компонентов крови ограничено необходимостью работы в асептических условиях и доступностью специализированного оборудования:
- Рефрижераторной центрифуги.
- Экстрактора плазмы.
- Рефрижератора с постоянной температурой 4-6С.
- Низкотемпературной камеры хранения с температурой ниже -20С.
- Других запасных средств - таких как мешки для транспортировки плазмы (сухой), экстракторные пробирки, зажимы и герметики.
Цельная кровь
Свежая цельная кровь - самый легкий путь получения материала, пригодного для трансфузии. Поэтому она имеет самый широкий спектр клинического применения и показана при всех типах анемии, наследственной или приобретенной коагулопатии и нарушениях функции тромбоцитов. Поскольку цельная кровь является первичным источником трансфузии при очень небольшой практике для собак и предпочтительна для кошек, это делает излишним производство других препаратов из собранной крови.
Применение консервированной (до 30-35 дней) цельной крови, если она собрана с CPDA-1, ограничивается всеми типами анемии и не пригодно при гемостатической болезни (1,3-7).
Консервированные эритроциты
Консервированные эритроциты (PRBCs) содержат большое количество клеточной жидкости, остающейся в первичном мешке для крови после того, как около 80% плазмы и CPDA-1 были асептически введены в мешок для транспортировки. Их приготавливают, помещая мешок в рефрижераторную центрифугу на 15 минут, при скорости вращения 5.000 g и температуре около 3-6°С. Герметично закрытые в мешке PRBCs сохраняют охлажденными при 3-6°С и применяют, пока не истечет срок годности (около 30 дней), не наступит обесцвечивание или какая-либо аномалия. Перед переливанием мешок необходимо согреть. Если для облегчения переливания потребуется развести содержимое, то следует добавить только хлористый натрий. PRBCs показаны для пополнения запаса эритроцитов (как, например, при состояниях хронической анемии) и особенно в ситуациях, когда у больного возникает риск перегрузки дополнительным объемом жидкости. PRBCs можно использовать в комбинации с кристаллоидами для лечения острой кровопотери.
Плазма
Плазма представляет собой супернатант, и, как и PRBCs, готовится центрифугированием цельной крови собаки. Если плазму готовят с помощью рефрижераторной центрифуги, разделяют в течение б часов сбора и немедленно замораживают (-18°С или менее), то ее называют Свежезамороженной Плазмой (FFP) и используют для восстановления факторов свертывания, включая нестойкие компоненты. Срок хранения составляет 1 год при -40°С без утраты активности факторов свертывания. Плазму следует оттаивать при 30-37°С и вводить как можно скорее после оттаивания. Та плазма, которая была получена более чем через 6 часов после взятия крови или Свежезамороженная Плазма, неиспользованная в течение 24 часов после оттаивания или 1 года хранения, маркируется как Замороженная Плазма (FP). Она все еще обладает некоторыми факторами коагуляционной активности (напр., Фактором IX), но в основном используется как источник альбумина. Криопреципитат (СР) может быть приготовлен из FPP. Процедура состоит из продолжительного оттаивания, после чего супернатант удаляется в отдельный мешок. СР - компонент крови, богатый фибриногеном и FVIII, очень полезный для лечения гемофилии А и болезни фон Виллебранда. Остаточная плазма применяется и при других коагулопатиях, за исключением упомянутых выше, и в качестве источника альбумина (1,3-7). В общем, плазма может быть получена и из цельной крови с CPDA-1 до истечения срока годности, но этот продукт имеет очень ограниченное применение и пригоден только в качестве источника альбумина.
Тромбоциты
Обогащенная тромбоцитами плазма (PRP) готовится в течение 6 часов после взятия крови путем мягкого центрифугирования (т. е. 2.000 g в течение 3 минут) резервуара цельной крови, собранной с CPDA-1. Супернатант переносят в дополнительный мешок, используя экстрактор плазмы. Срок хранения - до 3-х дней при 3-6°С и постоянном встряхивании (1,3-7).
Подбор донора - реципиента по группам крови (совместимость)
Окончательную уверенность в том, что эритроциты донора действительно подходят реципиенту и впоследствии будут эффективно выполнять функцию переносчика кислорода в организме могут дать только результаты перекрестной пробы. Эта процедура состоит из двух этапов (3, 4, 6-8).
Большая перекрестная проба
Эритроциты донора (промытые три раза и взвешенные в 3-5% физ. растворе) приводятся в контакт с гепаринизированной плазмой или сывороткой крови реципиента (одна или две капли каждая). Более быстрая версия пробы, использующая мазки крови, менее пригодна, так как только сыворотка или плазма с высоким титром антиэритроцитарных антител будет демонстрировать агглютинацию или гемолиз (видимый уже через несколько минут) (Рисунок 3). При выполнении в лабораторных пробирках или на хороших платах тест занимает больше времени, зато позволяет определить низкий титр антиэритроцитарных антител при агглютинации или гемолизе (Рисунок 4-6). Такие реакции указывают на несовместимость групп крови донора и реципиента.

Рисунок 3 Метод приготовления четких слайдов, использованный для тестирования совместимости крови. Одна капля (50-100 мкл) сыворотки или гепаринизированной плазмы и одна капля 3-5% суспензии эритроцитов в физ. растворе помещаются на каждое предметное стекло. На слайде 1 можно видеть гемагглютинацию, на слайде 2 - отрицательную или контрольную реакцию и на слайде 3 - гемолиз.
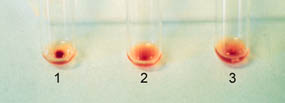
Рисунок 4 Пробирочный метод для тестирования совместимости крови. Две капли (100-200 ил) сыворотки или гепаринизированной плазмы и две капли 3-5% эритроцитарной суспензии в физ. растворе поменяются в каждую пробирку. Гемагглютинация может быть видна в пробирке 1, отрицательная или контрольная реакция - в пробирке 2, и гемолиз - в пробирке 3.
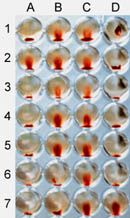
Рисунок 5 Метод микротитровальных плат,использованный длятестирования совместимости крови, иллюстрирующий гемагглютинацию.25 ил сыворотки или гепаринизированной плазмы и 25 ил 3% суспензии эритроцитов в физ. растворе добавляются в каждую лунку. Микротитровальную плату затем помещают в термостат при 37С и результат реакции виден через 15 и 30 минут. Плата слегка наклоняется, позволяя небольшой массе осажденных на дне лунки эритроцитов подойти к "линии", указывающей на отрицательную реакцию (номера лунок А2; В1, 2, 3, 4, 5; Cl, 2, 3, 4. 5, 6, 7; D7). Положительные реакции наблюдают в тех лунках, где небольшая масса осадка эритроцитов в "полулунной "форме (агрегат) видна на нижней стороне лунки (номера лунок А), 3, 4, 5. 6, 7; В6, 7; DI, 2, 3, 4, 5, 6).

Рисунок 6 Метод микротитровальных плат, использованный для тестирования совместимости крови, иллюстрирующий гемолиз. 25 ил сыворотки или гепаринизированной плазмы и 25 ил 3% суспензии эритроцитов в физ. растворе добавляются в каждую лунку. Температура инкубации и время чтения реакции, как на Рисунке 5. Отрицательные реакции наблюдаются в лунках, где пока еще может быть видна осажденная эритроцитарная масса (номера лунок А1, 2, 3, 4, 5, 6, 7; С4, 5; D4, 5, 6, 7). Положительные реакции можно наблюдать в лунках с одинаковым розовым окрашиванием, где эритроцитарная масса исчезала вследствие гемолиза (номера лунок В1, 2, 3, 4, 5, 6, 7; Cl, 2, 3, 6, 7; DI, 2, 3).
Малая перекрестная проба
Она идентична большой перекрестной пробе, но при проведении теста используются эритроциты от реципиента и сыворотка или гепаринизированная плазма от донора. В этой пробе та же иммунологическая позитивная реакция указывает на несовместимость групп крови донора и реципиента.
Перекрестная проба для собак, если позволяет время, должна быть выполнена при трех различных температурах 4°С, 25°С и 37°С или, по крайней мере, при 25°С. При проведении пробы в лабораторных пробирках мягкое центрифугирование (т. е. 1.000 g в течение 2 минут) после контакта промытых эритроцитов с сывороткой крови поможет демонстрации гемолиза (3, 4, 6, 7). Эта перекрестная проба обязательна для всех собак, которым ранее делали переливание, и для каждой кошки. Даже если группа крови реципиента и/или донора-кошки уже известна как АВ, здесь могут быть естественные или иммунные антитела, связанные с другими факторами группы крови, которые не были до сих пор хорошо определены у кошек (3,4,6-8).
Процедура переливания крови
Введение цельной крови или PRBCs реципиенту осуществляется внутривенным путем через мозговую либо яремную вены, при этом используют 20G иглу-бабочку или венозный катетер. Предварительно кровь должна быть согрета до комнатной температуры, которая не должна превышать 37С (Рисунок 7). Применение перистальтических насосов не рекомендуется из-за возможности чрезмерного гемолиза. Следует использовать для подачи крови набор с фильтром для профилактики введения мелких сгустков. Если рецепиент очень мал в размере или демонстрирует значительную гипотонию, то кровь можно также вводить через костный мозг в проксимальный конец бедренной или плечевой кости, где она абсорбируется со скоростью приблизительно одна капля в минуту (1,3, 6-8) (Рисунок 8).
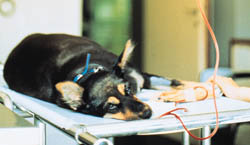
Рисунок 7 Собака, получающая трансфузию крови через мозговую вену.
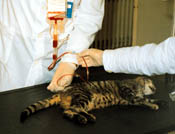
Рисунок 8 Внутрикостная трансфузия крови у кошки, находящейся под действием седативных препаратов. Используется тот же участок, что и при биопсии костного мозга
Скорость внутривенной трансфузии цельной крови или PRBCs должна зависеть от клинического состояния реципиента. В первые 30 минут скорость вливания должна быть около 0,25 мл/кг; нормоволемическим больным кровь следует вводить со скоростью, не превышающей 5 мл крови на кг веса тела (ВТ) каждый час. Этот объем можно осторожно повышать: у гиповолемических особей - до 20 мл/кг ВТ/час; в то время как у больных, страдающих сердечно - сосудистой недостаточностью, отток следует снижать до 0,5-1,0 мл/кг ВТ/час (1,3, 4, 6-8).
Количество крови (мл), которое нужно перелить больному, может быть рассчитано по следующей формуле:
|
|
(требуемый PCV - PCV реципиента) |
|
K x BT x |
|
|
|
донор PCV |
где К является коэффициентом, связанным с объемом крови для каждого вида (88 для собак и 66 для кошек), ВТ - вес тела (в килограммах реципиента), и PCV донора определяется из расчета объема антикоагулянта. Для собак вместо примененного PCV в вышеупомянутой формуле можно ввести значение гемоглобина (Hgb) - в этом случае величина К снижается до 70. Проще говоря, введение 2 мл цельной крови или 1 мл PRBCs на кг ВТ повышает PCV реципиента на 1% (1,3,4, 6-8).
Переливают различные виды препаратов плазмы, предварительно согретых до 37°С в водяной бане, используя комплект с проточным фильтром. В общем, окончательная дозировка составляет 6-10 мл/кг/час. При активном кровотечении, вызванном недостаточностью функции свертывания, предлагается 6-10 мл/кг ВТ FFP 2-3 раза в день в течение 3-5 дней, пока продолжается кровотечение. СР следует вводить в течение 6 часов со скоростью 12-20 мл/кг ВТ каждые 10-12 часов до полной остановки кровотечения (1, 3, 4, 6-8).
Реакции на трансфузию
Осложнения трансфузии могут быть классифицированы как острые или замедленные и иммунные или неиммунные, но есть различия и между видами (3, 4, 6,7). У собак, - из-за того, что они имеют низкое количество естественно возникающих антител, - острые реакции на трансфузию обычно вызваны сенсибилизацией вследствие ранее проведенной несовместимой трансфузии, особенно когда в реакции участвует DEA 1 антиген. На самом деле у реципиента, сенсибилизированного к DBA 1, трансфузированные эритроциты с позитивной реакцией на DEA 1 имеют очень короткое время циркуляции, исчезая из кровообращения примерно через 10 минут (3, 4, 6, 7).
У кошки кровь, несовместимая с АВ, вызывает серьезные гемолитические реакции из-за естественного появления аллоантител. Из-за более высокого титра антител к А-антигену у кошек типа В по сравнению с антителами к В-антигену у кошек типа А, трансфузии, несовместимые по АВ, вызывают более тяжелые реакции у кошек типа В, чем у кошек типа А (3, 4, 6-8).
У обоих видов острая иммунная реакция на трансфузию приводит к гемоглобинемии, гемоглобинурии, лейкоцитозу со сдвигом влево и к эритрофагоцитозу. Клинические проявления болезни: беспокойство, гипотония, слюнотечение, рвота, недержание кала и мочи и лихорадка. Шок, крапивница и смерть возникают намного реже. У здоровых собак были случаи обратимой нефропатии, у больных же собак результатом трансфузии может быть диссеминированная внутрисосудистая коагуляция и олигурическая почечная недостаточность. Подход к лечению последствий трансфузии в основном схож с лечением шока большим количеством кристаллоидных жидкостей, глюкокортикоидов и поддержанием экскреции мочи. Замедленная иммунная реакция на трансфузию, вызванная введеннием несовместимых RBCs (эритроцитов), индуцирует медленный гемолиз, приводящий к билирубинемии,билирубинурии и необъяснимому снижению PCV после трансфузии (3,4, 6, 7).
Острые неиммунологические реакции характеризуются главным образом лихорадкой. Они могут возникать вследствие бактериальной контаминации крови или реакции между антигеном и антителом, вовлекающей лимфоциты, гранулоциты или тромбоциты. Эта реакция может быть самокупирующейся или ее можно вылечить просто жаропонижающими или антибактериальными препаратами. Иногда возникает реакция типа крапивницы с эритемой, сыпью и зудом вследствие аллергической реакции на растворимый фактор в донорской крови (например, IgE или биоактивные амины) (Рисунок 9). В этом случае рекомендуется применять антигистаминные препараты. Возбуждение, рвота, кашель, тахикардия, одышка и цианоз - все это клинические признаки повышенной нагрузки на кровообращение, чего можно избежать соблюдением рекомендаций врача относительно дозы вводимой крови, медленным введением ее и применением консервированных эритроцитов (3, 4, 6, 7).
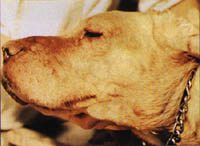
Рисунок 9 Собака с симптомами крапивницы (припухшие губы, отек век и отечные бляшки на коже).
Однако, при трансфузии могут возникнуть и случайные малые осложнения. Например, случается интоксикация от цитрата, если большие количества консервированной крови вводятся быстро или обычно, но больному животному с нарушенной функцией печени. Иногда от хелации кальция возникает гипокальциемия, ее можно вылечить замедлением скорости вливания или, по необходимости, медленным внутривенным введением глюконата кальция. Гиперкалиемия, которая, как сообщалось, возникает после переливания крови у людей, не появляется у собак и кошек; потому что их эритроциты имеют более низкое содержание калия (3, 4, 6, 7).
Группы крови и изоэритролиз новорожденных
Знание групп крови сделало возможным диагностику и профилактику феномена неонатального изоэритролиза -очень важного заболевания новорожденных, особенно у кошек. Неонатальный изоэритролиз, наряду с другими возможными причинами, рассматривают как ответственный за “Синдром Анемичного Котенка” - основную проблему в некоторых колониях кошек, вызванную высокой частотой группы крови В. Изоэритролиз новорожденных возникает, когда котята с группой крови А сосут молозиво у кошки с группой крови В, которая была спарена с котом группы крови А. Естественно возникающие антитела к А-анигену концентрируются в молозиве кошек группы крови В, и, поглощаемые котятами, абсорбируются и вступают в связь с их эритроцитами. Клинические симптомы включают анорексию, задержку роста, билирубинурию, желтуху, анемию и даже смерть, часто через несколько дней. Изоэритролиз новорожденных теперь может быть диагностирован у котят (Проба Кумбса, вероятно, окажется положительной) и вылечен всего лишь тем, чтобы в первые 24 часа после рождения отдать их на кормление другой кормящей кошке без специфических антител, направленных против эритроцитарных антигенов. Этого заболевания можно избежать и гемотипированием кошек до спаривания (3, 4, 6-8).
Изоэритролиз новорожденных случается и у собак, но гораздо реже по сравнению с кошками из-за отсутствия естественно возникающих изоантител в высоких титрах. Изоэритролиз новорожденных может возникать у щенков, рожденных от суки, которая до этого получила при трансфузии несовместимую кровь, содержащую DBA 1 антиген. Патогенез, симптомы и профилактические меры -те же, что и у кошек (3, 4, 6, 7).
Заключение
Относительная простота систем групп крови у собак и низкая частота естественно возникающих изоантител у этого вида позволили ветеринарным врачам почти игнорировать несовместимость групп крови у больных, особенно при первой трансфузии. Желателен более тщательный выбор донора крови, который должен иметь отрицательную реакцию по меньшей мере на DEA 1. У кошки ситуация совсем другая, и неблагоприятные реакции могут возникнуть даже при первой трансфузии. Поэтому в лечении кошек важно определить группы крови и провести перекрестные пробы.
Другая проблема возникает при выборе донора, особенно из-за опасности передачи реципиенту разных болезней. Усилия исследователей направлены на производство безопасных препаратов крови и ее компонентов. В будущем для ветеринарного врача станут более доступными другие препараты и методы - такие, как аутотрансфузия, рекомбинантный FVIII, эритропоиэтин или другие факторы, стимулирующие колонии костного мозга, а также синтетические носители кислорода.
WALTHAM FOCUS VOL 6 NO 4 1996
СПИСОК ЛИТЕРАТУРЫ
1. Authement, J. M., Wolfsheimer, К. J. and Catchings, S. (1987). Canine blood component therapy: product preparation, storage, and administration. Journal of the American Animal Hospital Association, 23: 483^93.
2. Bell, К. (1983). The blood groups of domestic mammals. Agar, N. S. and Board, P. G. (eds). Red Blood Cells of Domestic Mammals. Elsevier Science Publishers, Amsterdam, pp. 163-164.
3. Chabanne, L., Peyronnet, L., Fournel, C., Meyer, F. and Rigal, D. (1994). I gruppi sanguigni dei carnivori domestici. Trasfusioni e malattie emolitiche neonatali. Summa, 11: 5-17.
4. Cotter, S. M. (1991). Comparative transfusion medicine. Advances in Veterinary Science and Comparative Medicine, 36. Academic Press, San Diego, p. 343.
5. Dodds, W. J. (1993). Update on animal blood banking services. Veterinary Practice Staff, 5: 2-7.
6. Hohenhaus, A. E. (1992). Transfusion medicine. Problems in Veterinary Medicine, 4. J. B. Lippincott, Philadelphia, p. 670.
7. Kristensen, A. T. and Feldman, B. F. (1995). Blood banking and transfusion medicine. Ettinger, S. J. and Feldman, E. C. (eds). Textbook of Veterinary Internal Medicine. Diseases of the Dog and Cat. W. B. Saunders, Philadelphia, pp. 347-360.
8. Lubas, G. and Continanza, R. (1993). Recenti acquisizioni sulle caratteristiche immunoematologiche del gatto e relative applicazioni nella clinica. Veterinaria, 7: 5-11.
9. Swisher, S. N. and Young, L. E. (1961). The blood grouping systems of dogs. Physiology Reviews, 41: 495-520.
Другие статьи этого раздела
Malassezia pachydermatis и кожное заболевание у собакАспекты наследственного заболевания глаз у породистой собаки
Влияние диеты
Волчанки
Вопросы диагностики и терапии почечной недостаточности
Гастриты, язвы и бактерии Helicobacter spp, у людей, собак и кошек
Гастрэктазия у собак
Гепатоэнцефалопатия у кошек и собак
Гиперсенсибилизация на "укусы" насекомых у плотоядных
Демодекоз собак
Демодекоз у собак2
Диетотерапия заболеваний печени у собак
Диетотерапия почечной недостаточности
Коронавирусные инфекции кошек
Методика наложения хирургических швов на мягкие ткани: современные рекомендации для собаки и кошки
Может ли диета изменить поведение?
Наблюдения за течкой и беременностью у суки
Острая диарея
Отравление парацетамолом
Патология молочных желез у собаки и кошки
Переливание крови у кошек и собак
Пищевая клетчатка и ожирение: Правда и вымысел
Противоинфекционная терапия глаза
Рациональная антибиотикотерапия пиодермитов
Рентгенограммы, специально предназначенные для постановки диагноза у больного
Снижение веса тела кошек, страдающих ожирением, методом контролируемого потребления калорий
Составные элементы анализа мочи
Спинальные травмы: клиническая оценка и лечение
Спинномозговая пункция
Сухой корм для кошек и состояние их мочевых путей
Хирургическое лечение Дистихиазиса
ПРЕПАРАТЫ
противомикробныеантигипоксанты
антигельминтные
диагностические
функции почек
гепатотропные средства
процессы иммунитета
антипедикулезные
мускулатура матки
грибковые заболевания
фармакологические группы
онкологических заболевания
ПАРТНЕРЫ
Документы
психоз у собакбешенство у животных
Альтернативы гемотрансфузии
Анализ опухолей
Ангиография у плотоядных
Атопические отиты
возбудитель чумы плотоядных
бабезиоз у собак
Биохимические характеристики крови
| НА ГЛАВНУЮ |